Suatu reaksi kimia dapat disebut sebagai reaksi reversibel jika suatu reaktan dapat kembali lagi menjadi suatu produk. Reaksi reversibel ini bersifat dinamis, yaitu dapat berlangsung bolak balik secara terus menerus dengan nilai laju reaksi yang sama baik laju reaksi ke arah reaktan maupun ke arah produk. Keadaan ini dinamakan keadaan setimbang atau juga dikenal dengan kesetimbangan kimia. Reaksi yang terjadi pada keadaan setimbang ini disebut sebagai sistem kesetimbangan.
Karena kesetimbangan ini memiliki sifat yang dinamis, maka gangguan-gangguan oleh suatu faktor tertentu sering kali menimpa reaksi yang berjalan pada keadaan yang setimbang, sehingga kesetimbangan reaksi akan mengalami pergeseran.
Asas Le Chatelier menyatakan bahwa dalam sistem kesetimbangan, perubahan salah satu variabel yang menentukan kesetimbangan akan menggeser kesetimbangan ke arah untuk meniadakan efek-efek perubahan dalam variabel itu (Levine,2009). Ketika dilakukan suatu perubahan kondisi seperti konsentrasi, tekanan, temperatur, dan volume pada suatu sistem kesetimbangan, maka sistem tersebut akan mengkondisikan diri sedemikian rupa dan nantinya akan ada kesetimbangan baru yang dihasilkan.
Respon Kesetimbangan Terhadap Tekanan
Komposisi kesetimbangan bergantung pada tekanan. Pada gas sempurna, ketika A 2B dalam keadaan setimbang) diberikan tekanan, maka jumlah molekul b akan berkurang, sementara molekul A akan bertambah. Kondisi seperti ini akan terus terjadi sehingga nilai K (konstanta kesetimbangan) tidak mengalami perubahan, kerena K ini tidak memiliki ketergantungan terhadap tekanan. Hal ini sesuai dengan asas Le Chatelier. Pada kasus di atas, dengan diberikannya tekanan pada suatu sistem dalam keadaan setimbang, sistem akan mengkondisikan diri untuk meminimalkan tekanan yaitu dengan cara mengurangi jumlah molekul B sehingga terjadi pergesertan kesetimbangan ke arah kiri (A ← 2B) (Atkins, 1993).
2B dalam keadaan setimbang) diberikan tekanan, maka jumlah molekul b akan berkurang, sementara molekul A akan bertambah. Kondisi seperti ini akan terus terjadi sehingga nilai K (konstanta kesetimbangan) tidak mengalami perubahan, kerena K ini tidak memiliki ketergantungan terhadap tekanan. Hal ini sesuai dengan asas Le Chatelier. Pada kasus di atas, dengan diberikannya tekanan pada suatu sistem dalam keadaan setimbang, sistem akan mengkondisikan diri untuk meminimalkan tekanan yaitu dengan cara mengurangi jumlah molekul B sehingga terjadi pergesertan kesetimbangan ke arah kiri (A ← 2B) (Atkins, 1993).
 2B dalam keadaan setimbang) diberikan tekanan, maka jumlah molekul b akan berkurang, sementara molekul A akan bertambah. Kondisi seperti ini akan terus terjadi sehingga nilai K (konstanta kesetimbangan) tidak mengalami perubahan, kerena K ini tidak memiliki ketergantungan terhadap tekanan. Hal ini sesuai dengan asas Le Chatelier. Pada kasus di atas, dengan diberikannya tekanan pada suatu sistem dalam keadaan setimbang, sistem akan mengkondisikan diri untuk meminimalkan tekanan yaitu dengan cara mengurangi jumlah molekul B sehingga terjadi pergesertan kesetimbangan ke arah kiri (A ← 2B) (Atkins, 1993).
2B dalam keadaan setimbang) diberikan tekanan, maka jumlah molekul b akan berkurang, sementara molekul A akan bertambah. Kondisi seperti ini akan terus terjadi sehingga nilai K (konstanta kesetimbangan) tidak mengalami perubahan, kerena K ini tidak memiliki ketergantungan terhadap tekanan. Hal ini sesuai dengan asas Le Chatelier. Pada kasus di atas, dengan diberikannya tekanan pada suatu sistem dalam keadaan setimbang, sistem akan mengkondisikan diri untuk meminimalkan tekanan yaitu dengan cara mengurangi jumlah molekul B sehingga terjadi pergesertan kesetimbangan ke arah kiri (A ← 2B) (Atkins, 1993).
Jika kesetimbangan gas sempurna A 2B, maka konstanta kesetimbangannya dapat diketahui dengan persamaan sebagai berikut (Atkins,2006):
2B, maka konstanta kesetimbangannya dapat diketahui dengan persamaan sebagai berikut (Atkins,2006):
 2B, maka konstanta kesetimbangannya dapat diketahui dengan persamaan sebagai berikut (Atkins,2006):
2B, maka konstanta kesetimbangannya dapat diketahui dengan persamaan sebagai berikut (Atkins,2006):
Adanya perubahan tekanan hanya akan mempengaruhi sistem kesetimbangan pada fasa gas dengan fasa gas. Untuk sistem kesetimbangan pada fasa padat maupun fasa cair, adanya perubahan tekanan tidak akan mempengaruhi sistem.
Dalam hukum gas ideal, jumlah mol gas akan berbanding lurus dengan besar suatu tekanan. Apabila suatusistem kesetimbangan di naikkan tekanannya, maka jumlah mol gas pada sistem kesetimbangan itu juga akan bertambah, sehingga kesetimbangan bergeser ke arah reaksi dengan jumlah mol yang lebih kecil. Dan apabila tekanannya diturunkan, maka kesetimbangan bergeser ke arah reaksi dengan jumlah mol yang lebih besar.
Respon kesetimbangan dapat dinyatakan secara kuantitatif. Efek tekanan dapat diketahui dengan memperhatikan kesetimbangan umum pada gas sempurna. Untuk meminimalkan efek tekanan secara kuantitatif, dimisalkan terdapat senyawa A dengan kuantitas n (senyawa B ditiadakan). Dalam kondisi setimbang, kuantitas senyawa A menjadi (1-α)n sementara kuantitas senyawa B menjadi 2αn, sehingga nilai fraksi mol yang terdapat dalam kesetimbangan adalah (Atkins, 2006):
Adapun konstanta kesetimbangannya adalah:
Yang disusun kembali menjadi:
Respon Kesetimbangan Terhadap Temperatur
Dilihat dari segi kualitatif, adanya pengaruh suhu terhadap reaksi kesetimbangan kimia berkaitan dengan reaksi endoterm serta eksoterm. Reaksi eksotermis merupakan reaksi yang berlangsung secara spontan dan melepaskan energi dalam proses reaksinya serta dinyatakan dalam ΔH yang bernilai negatif. Adapun reaksi endotermis merupakan reaksi yang dalam prosesnya membutuhkan kalor atau energi serta dinyatakan dalam ΔH yang bernilai positif (Keenan,1984).
Dalam sistem kesetimbangan yang bersifat eksoterm, adanya kenaikan temperatur akan membuat jumlah reaktan bertambah. Sementara dalam sistem kesetimbangan yang bersifat endoterm, adanya kenaikan temperatur akan membuat jumlah produk bertambah (Atkins, 1993).
Nilai temperatur yang meningkat sama artinya dengan adanya peningkatan kalor atau energi pada sistem, dan situasi seperti ini mendesak kalor yang diserap oleh sistem harus dipergunakan, sehingga reaksi bergerak ke arah endotermis, dan begitu pula sebaliknya (Keenan, 1984).
a) Persamaan Van’t Hoff
Persamaan van’t Hoff menyatakan kemiringan plot dari konstanta ketimbangan yang disimbolkan oleh K (khusunya ln K) sebagai fungsi dari besaran temperatur. Persamaannya dapat diungkapkan sebagai berikut (Atkins, 2006):
Atau bisa juga diungkapkan sebagai berikut:
Pada persamaan yang pertama, nilai d ln K/dT < 0 (sehingga d K/dT < 0). Hal ini berlaku untuk reaksi kesetimbangan yang bersifat eksoterm pada kondisi yang standar (ΔH⁰ < 0). Kemiringan kurva yang menunjukkan ln K bernilai negatif. Dan karena inilah nilai K sendiri akan berkurang jika temperatur dinaikkan. Maka, dalam kondisi reaksi yang eksoterm, meningkatnya nilai temperatur akan mengakibatkan kesetimbangan mengalami pergeseran yang menjauhi produk. Begitu pula sebaliknya yang terjadi dalam kondisi reaksi endoterm.
Dalam persamaan fungsi gibbs ΔG = ΔH – T ΔS atau ditulis dalam bentuk lain sebagai –ΔG/T = -ΔH/T + ΔS, yang memberikan keterangan bahwa dalam bahasan ini pun kaitannya entropi sangat erat dengan sistem reaksi pada sistem yang terisolasi. Apabila reaksi tersebut eksoterm, persamaan -ΔH/T sama artinya dengan perubahan positif dari nilai entropi lingkungan pada suatu sistem reaksi, serta merupakan gaya yang mendorong bergesernya reaksi ke arah pembentukan produk. Jika terjadi kenaikan temperatur nilai -ΔH/T akan berkurang dan nilai entropi lingkungan akan bertambah sebagai gaya pendorong yang kurang kuat. Sehingga kesetimbangan di arah kanan akan berkurang. Apabila reaksi itu adalah reaksi endoterm, yang menjadi gaya pendorongnya yaitu pertambahan nilai entropi pada sistem reaksi. Perubahan yang terjadi pada entropi lingkungan yang tidak diinginkan nilainya akan berkurang jika temperaturnya ditingkatkan (nilai ΔH/T akan lebih kecil), sehingga reaksi mengalami pergeseran ke arah produk (Atkins, 1993).
Pengaruh temperatur terhadap sistem kesetimbangan kimia dapat juga di artikan sebagai perubahan dalam distribusi Boltzman dengan suhu dan pengaruh perubahan. (a) Dalam reaksi endotermis, nilai populasi B bertambah dibandingkan A sebagai adanya peningkatan temperatur. (b) Dalam reaksi eksotermis, yang terjadi adalah sebaliknya (Atkins, 2006).
b) Nilai K Pada Temperatur Berbeda
Untuk mencari nilai K (Konstanta Kesetimbangan) pada T2 dengan nilai
K1 pada nilai T1, , dengan mengintegrasikan persamaan  , maka didapatkan persamaan sebagai berikut (Atkins, 1993):
, maka didapatkan persamaan sebagai berikut (Atkins, 1993):
 , maka didapatkan persamaan sebagai berikut (Atkins, 1993):
, maka didapatkan persamaan sebagai berikut (Atkins, 1993):
Integral yang terdapat pada sisi kiri dapat dinyatakan sebagai ln K2 – ln K1. Jika kita asumsikan nilai ΔH◦ mengalami sedikit perubahan dengan temperatur tertentu, maka dapat dikeluarkan dari integral. Dan persamaannya adalah sebagai berikut:
Daftar Pustaka
Atkins, P.W. 1993. Kimia Fisika Jilid 1 Edisi keempat. Jakarta: Erlangga
Atkins, P.W and Paula J.D. 2006. Physical Chemistry Eighth Edition. New York: Oxford University Press
Keenan, Charles W. 1994. Kimia Untuk Universitas. Jakarta: Erlangga
Levina, Ira N. 2009. Physical Chemistry Sixth Edition. New York: McGraw-Hill
Vinna Siti Hardianti Fauzi (16630076)



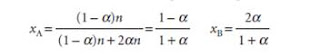



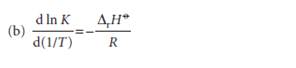



.jpeg)
