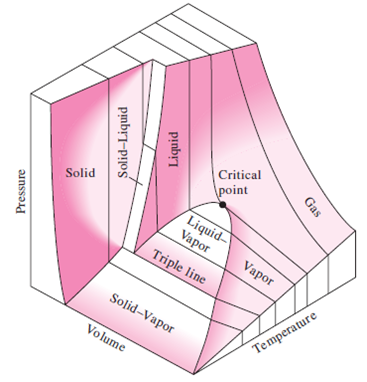
Fase didefinisikan sebagai setiap bagian yang homogen dan berbeda secara fisik dari suatu sistem yang dibatasi oleh permukaan dan secara mekanis dapat dipisahkan dari bagian lain dari sistem. Fasa bisa berupa gas, cair atau padat. Ini sangat homogen dan berbeda dari setiap fase lain yang ada dalam sistem. Harus ada batas yang pasti antara dua fase. Batas ini dikenal sebagai antarmuka.
Udara merupakan fase tunggal hanya karena mengandung campuran nitrogen, oksigen, karbon dioksida, uap air, dan lan-lain. Suatu sistem yang hanya terdiri dari satu fasa dikatakan homogen. Campuran dua cairan yang tak dapat bercampur seperti air dan benzena, akan ada dalam dua fase cairan yang berbeda dan di samping itu akan ada fase uap. Dengan demikian akan ada tiga fase yang masing-masing terpisah dari yang lain oleh permukaan pembatas yang terdefinisi dengan baik.
Suatu sistem yang terdiri dari lebih dari satu fase dikatakan heterogen. Ketika berbagai fase berada dalam ekuilibrium satu sama lain dalam sistem heterogen, tidak akan ada transfer energi atau massa dari satu fase ke fase lainnya. Ini berarti bahwa pada kesetimbangan, berbagai fase harus memiliki suhu dan tekanan yang sama dan komposisi masing-masing harus tetap konstan sepanjang waktu. Reaksi reversibel homogen dapat dipelajari dengan menggunakan hukum aksi massa. Untuk reaksi reversibel heterogen, aturan fase yang diberikan oleh Williard Gibbs digunakan.
Aturan Fase
Aturan fase menyatakan bahwa "Jika kesetimbangan antara sejumlah fase tidak dipengaruhi oleh gaya gravitasi, atau listrik, atau gaya magnet, atau oleh aksi permukaan tetapi hanya dipengaruhi oleh suhu, tekanan dan konsentrasi, maka jumlah derajat kebebasan (F ) dari sistem ini terkait dengan jumlah komponen (C) dan jumlah fase (P) dengan persamaan aturan fase berikut:
F = C - P + 2
Fase (P)
Fase didefinisikan sebagai "bagian sistem yang terpisah secara fisik, unik, dan terpisah secara mekanis, yang dipisahkan dari bagian sistem lainnya oleh permukaan batas tertentu". Contoh:
1. Fase cair:
Jumlah fase cair tergantung pada jumlah cairan yang ada dan kemampuan interaksinya.
I. Jika dua cairan tidak dapat bercampur, mereka akan membentuk dua fasa cair terpisah. Contoh: benzena dan air
II. Jika dua cairan dapat bercampur mereka akan membentuk satu fasa cair saja. Contoh: alkohol dan air
2. Fase padat
Setiap solid membentuk fase terpisah. Jumlah fase padat tergantung pada jumlah padatan yang ada di dalamnya. Contoh: campuran beberapa belerang, tetapi campurannya dalam fase terpisah.
3. Fase gas
Karena campuran gas benar-benar tercampur dalam semua proporsi, sehingga hanya akan membentuk satu fasa saja. Contoh: campuran N2 dan H2 membentuk satu fasa saja.
4. Larutan zat dalam pelarut hanya terdiri dari satu fasa saja, misalnya larutan glukosa.
5. Campuran heterogen seperti:
CaCO3 (s) → CaO (s) + CO2 (g)
terdiri dari tiga fase (yaitu, dua padatan dan satu gas).
Dalam reaksi kesetimbangan :
Fe (s) + H2O (g) → FeO (s) + H2 (g)
Ada dua fase padat, Fe dan FeO dan satu fase gas yang terdiri dari H2O (g) dan H2 (g). Jadi tiga fase ada dalam kesetimbangan.
6. Pada titik beku, air terdiri dari tiga fase:
Es (s)↔ Air (l)↔ Uap air (g)
7. Larutan padat homogen berupa garam membentuk fase tunggal.
Contoh: garam Mohr [FeSO4. (NH4) 2SO4.6H2O] solusi memiliki fase tunggal.
Komponen (C)
Komponen didefinisikan sebagai "jumlah terkecil konstituen variabel independen, dengan cara komposisi setiap fase dapat dinyatakan dalam bentuk persamaan kimia". Contoh:
i) Dalam sistem air.
Es (s)↔ Air (l)↔ Uap air (g)
Komponen kimia dari ketiga fase adalah H2O dan karenanya merupakan salah satu sistem komponen.
ii) Belerang ada dalam empat fase yaitu rhombik, monoklinik, cair dan uap, tetapi komposisi kimia dari semua fase adalah S. Dengan demikian adalah sistem satu komponen.
iii) Sistem larutan NaCl jenuh terdiri dari garam padat, larutan garam dan uap air. Komposisi kimia dari ketiga fase dapat dinyatakan dalam bentuk NaCl dan H2O. Oleh karena itu ini adalah sistem dua komponen.
iv) Dalam dekomposisi termal CaCO3,
CaCO3 (s) → CaO (s) + CO2 (g)
Komposisi masing-masing dari tiga fase dapat dinyatakan dalam setidaknya dua variabel independen konstituen, CaCO3, CaO dan CO2. Misalkan CaCO3 dan CaO dipilih sebagai dua komponen, maka komposisi fase yang berbeda direpresentasikan sebagai berikut:
Fase: CaCO3 = CaCO3 + CaO
Fase: CaO = CaCO3 + CaO
Fase: CO2 = CaCO3 - CaO
Jadi, ini adalah sistem dua komponen.
v) Dalam kesetimbangan, Fe (s) + H2O (g)→ FeO (s) + H2 (g), komponen minimum yang diperlukan untuk menyatakan komposisi setiap fase adalah tiga. Jadi itu adalah sistem tiga komponen.
vi) Dalam disosiasi NH4Cl, kesetimbangan berikut terjadi:
NH4Cl (s) → NH3 (g) + HCl (g)
Sistem ini terdiri dari dua fasa yaitu NH4Cl padat dan campuran gas yang mengandung NH3 + HCl. Ketika NH3 dan HCl hadir dalam jumlah yang setara, komposisi kedua fasa dapat diwakili oleh senyawa kimia NH4Cl yang sama dan karenanya sistem akan menjadi sistem satu komponen.
Tingkat kebebasan ( Derajat Kebebasan)
Tingkat kebebasan didefinisikan sebagai jumlah minimum faktor variabel independen seperti suhu, tekanan dan konsentrasi fase, yang harus diperbaiki untuk menentukan kondisi sistem sepenuhnya. Suatu sistem yang memiliki 1,2,3 atau 0 derajat kebebasan disebut univariat, bivariat, trivarian dan nonvarian masing-masing. Contoh:
i) Perhitungan sistem air
Es (s)↔ Air (l)↔ Uap air (g)
Tiga fase dapat berada dalam ekuilibrium hanya pada suhu dan tekanan tertentu. Oleh karena itu, ketika semua tiga fase hadir dalam kesetimbangan, maka tidak ada kondisi yang perlu ditentukan. Oleh karena itu sistem ini nol varian atau invariant atau tidak memiliki tingkat kebebasan. Dalam sistem ini jika tekanan atau suhu diubah, tiga fase tidak akan tetap berada dalam ekuilibrium dan salah satu fase menghilang.
ii) Pertimbangkan suatu sistem yang terdiri dari air yang bersentuhan dengan uapnya,
Air (l) ↔Uap air (g)
Untuk mendefinisikan sistem ini sepenuhnya, kita harus menyatakan suhu atau tekanan. Dengan demikian derajat kebebasan adalah satu dan sebuah sistem univarian.
iii) Untuk sistem yang hanya terdiri dari fase uap air, kita harus menyatakan nilai-nilai dari kedua suhu dan tekanan agar dapat sepenuhnya memahami sistem. Oleh karena itu sistem bivariat atau memiliki dua derajat kebebasan.
iv) Untuk campuran gas N2 dan H2, kita harus menyatakan baik tekanan maupun suhu, karena jika tekanan dan suhu ditetapkan, volume secara otomatis menjadi pasti. Oleh karena itu, untuk sistem gas, dua faktor harus dinyatakan untuk mendefinisikan sepenuhnya dan dengan demikian, ia memiliki dua derajat kebebasan atau sistem bivariat.
v) Pertimbangkan suatu sistem yang terdiri dari
NaCl (s) ↔ NaCl-air (aq) ↔ Uap air (g)
kita harus menyatakan suhu atau tekanan, karena kelarutan saturasi ditetapkan pada suhu atau tekanan tertentu. Oleh karena itu sistem ini bersifat univarian.
Kelebihan aturan Fase:
1. Berlaku untuk kesetimbangan fisik dan kimia.
2. Tidak memerlukan informasi mengenai molekul / mikro-struktur, karena itu berlaku untuk sistem makroskopik.
3. Salah satu metode yang mudah untuk mengklasifikasikan keadaan kesetimbangan dalam hal fase, komponen dan derajat kebebasan.
4. Dapat membantu kita untuk memprediksi perilaku suatu sistem, di bawah berbagai variabel yang berbeda.
5. Dapat menunjukkan bahwa sistem yang berbeda dengan derajat kebebasan yang sama berperilaku sama.
6. Dapat membantu dalam memutuskan apakah di bawah seperangkat ketentuan tertentu:
a) berbagai zat akan ada bersama-sama dalam kesetimbangan atau
b) beberapa zat yang ada akan saling dipertukarkan atau
(c) beberapa zat yang ada akan dihilangkan.
Kekurangan aturan Fase:
1. Hanya dapat diterapkan untuk sistem dalam kesetimbangan. Akibatnya, kesetimbangan adalah nilai kecil dalam hal sistem pencapaian keadaan ekuilibrium yang sangat lambat.
2. Hanya berlaku untuk sistem ekuilibrium tunggal dan tidak memberikan informasi mengenai kesetimbangan lain yang mungkin dalam sistem.
3. Dibutuhkan ke hati-hatian dalam memutuskan jumlah fase yang ada dalam keadaan kesetimbangan, karena hanya mempertimbangkan jumlah fase, bukan jumlah mereka. Jadi, jika ada jejak fase, ia hanya mencatat jumlah total fase.
4. Kondisinya menunjukkan bahwa semua fase sistem harus hadir secara bersamaan di bawah kondisi suhu dan tekanan yang identik.
DAFTAR PUSTAKA
Atkins. (1996). Kimia Fisika Jilid 1 Edisi Keempat. Jakarta: Penerbit Erlangga.
Hardeli, S. S. (1997). Kimia Fisika 1. Padang: Universitas Negeri Padang.
Mulyani, I. R. (2004). Common Textbook Edisi Revisi Kimia Fisik 1. Bandung: Universitas Pendidikan Indonesia.
Sukardjo. (2002). Kimia Fisika. Jakarta: PT Rineka Cipta.
Indra Nur Cahyo (16630051)
Keseimbangan Kimia, Jurusan Kimia Fakultas Sains dan Teknologi
Universitas Islam Negeri Maulana Malik Ibrahim Malang

.jpeg)
